Dobra ... po kiego grzyba komuś jakieś tam pH ... chyba tylko po to, aby pognębić
spokojnych ludzi, którzy w tym czasie mogliby robić milion innych ciekawszych
rzeczy niż wkuwać chemię, np. trochę zabalować.
Nie jest to jednak do końca prawda ... pH nie jest takie głupie, jak na pierwszy
rzut oka wygląda, a jego znajomość przydaje się w wielu sytuacjach ... na przykład,
gdy już posiądziesz tą magiczną umiejętność obliczania tajemniczego pH, to będziesz
mógł się nią podzielić z jakąś miłą koleżanką (lub kolegą) ... z którą później
będziesz mógł się umówić na jakąś imprezkę ... he he he ... tak czy owak, jak
widzisz wszystko prowadzi do dobrej zabawy.
No to wystarczy tego chachmęcenia, sprawdźmy o co w tym wszystkim chodzi???
A teraz ZAPOMNIJ o tym wszystkim o czym uczyli Cię do tej pory o pH ... pewnie
gadali coś o logarytmach i to w dodatku ujemnych ... aż dreszcze człowieka przechodzą
jak słyszy się takie pogańskie nazwy ... zresztą zaraz sam(a) zobaczysz,
że nie jest to wcale trudne !!
Zaczynamy bajkę ... w 1887 roku, za siedmioma górami, za siedmioma lasami żył
sobie pan, który nazywał się Svante Arrhenius. Svante był dosyć dociekliwym
człowiekiem i któregoś dnia zauważył, że niektóre związki chemiczne podczas
rozpuszczania w wodzie ulegają rozpadowi na kationy
(czyli atomy obdarzone ładunkiem dodatnim) i aniony (atomy
obdarzone ładunkiem ujemnym).
Zjawisko to nosi nazwę dysocjacji elektrolitycznej (lub
dysocjacji jonowej)
Te związki chemiczne, które rozpadły się na jony pod wpływem wody nazywa się
elektrolitami.
Zobacz na rysunek poniżej:
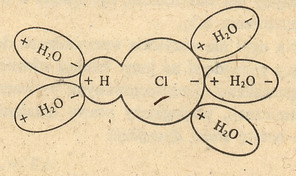
Widać tutaj cząsteczkę HCl otoczoną cząsteczkami wody. Te plusiki i minusiki
oznaczają, że cząsteczki te mają określone ładunki na swoich końcach. Takie cząsteczki
z ładunkami nazywa się cząsteczkami polarnymi albo
(dipolami - bo są di (dwu) polarne (biegunowe)).
No i taka biedna cząsteczka HCl otoczona przez te cząsteczki wody ulega rozerwaniu
na jony: H+ i Cl-.
Taką reakcję dysocjacji przedstawia się równaniem: HCl -> H+ +
Cl-
Ważne jest abyś zapamiętał(a), że jeżeli roztwór zawiera kationy to zawiera i
aniony, tak aby wypadkowy ładunek całego roztworu wynosił 0.
Często jest tak, że nie wszystkie cząsteczki wprowadzone do wody rozpadają się
na jony. Zostaje pewna liczba cząsteczek, które się nie rozpadły na jony (niezdysocjowanych).
Po pewnym czasie między jonami a cząsteczkami niezdysocjowanymi wytwarza się
stan równowagi. Mówi się, że jest to równowaga dynamiczna, co oznacza tylko
tyle, że w stanie równowagi cząsteczki niezdysocjowane rozpadają się dalej, ale
w tym samym czasie jony łączą się w cząsteczki tak więc ani jednych ani drugich
już nie przybywa ani nie ubywa.
Dobra ... a teraz warto by jakoś określić ten stan równowagi liczbowo, aby
można było to potem wykorzystać.
Służy do tego stała dysocjacji. Zobacz na to równanie:
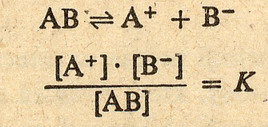
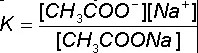 (tutaj na konkretnym przykładzie CH3COONa)
(tutaj na konkretnym przykładzie CH3COONa)
Jak widać jest to po prostu stosunek iloczynu stężeń jonów do stężenia cząsteczek
niezdysocjowanych w stanie równowagi roztworu. Prostackie ... prawda. Stała dysocjacji jest charakterystyczną właściwością danego elektrolitu
i nie zależy od stężenia.
Patrząc na to równanie powyżej wiadomo że im większa stała dysocjacji tym łatwiej
zachodzi proces rozpadania na jony.
Dobra, aby jakoś ilościowo określić całą sprawę warto by znać ilość cząsteczek
które uległy zdysocjowaniu do całkowitej ilości cząsteczek rozpuszczonych w
roztworze. Jest to nic innego jak stopień dysocjacji.
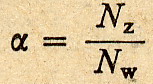
Wypada teraz powiedzieć słówko o zależności między stopniem dysocjacji a stałą
dysocjacji. Zależność tą definiuje prawo rozcieńczeń Ostwalda
i warto o nim pamiętać, bo znacznie ułatwia życie ... zwłaszcza przy rozwiązywaniu
niektórych zadań.
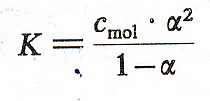
Proste jak drut ... zróbmy teraz mały przykładzik. Jeżeli w 1 litrze roztworu
znajduje się 1 mol związku AB, którego stopień dysocjacji wynosi 30%, to oznacza
że 30% cząsteczek związku AB rozpadnie się na A+ i B- (czyli
będzie to 0,3 mola), a 70% cząsteczek (0,7 mola) AB pozostanie nienaruszonych.
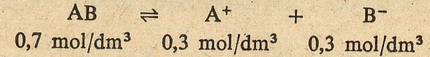
CZYLI ... stężenie molowe elektrolitu (czyli liczba moli wszystkich cząsteczek
zdysocjowanych i niezdysocjowanych wynosi 1 mol)
... stężenie molowe niezdysocjowanego elektrolitu wynosi 0,7 mola ....
... stężenie molowe jonów A+ jaki i B- wynosi 0,3 mola,
ponieważ z każdej cząsteczki powstaje jeden jon A+ i jeden jon B-.
Stopień dysocjacji zależy od
-) stężenia roztworu (wzrasta w miarę rozcieńczania - bo im bardziej rozcieńczasz
tym więcej cząsteczek się rozpada)
-) temperatury (wzrasta ze wzrostem temperatury - bo cząsteczkom łatwiej się rozpadać
w wyższej temperaturze - to chyba jasne)
Dobra teraz dwa słowa o podziale elektrolitów:
Jeżeli cząsteczki elektrolitu rozpadają się na jeden kation i jeden anion to są
to elektrolity binarne:

Jeżeli cząsteczki elektrolitu rozpadają się na różne ilości kationów i anionów
to są to elektrolity niebinarne.

Jak widzisz w elektrolitach niebinarnych z jednej cząsteczki powstaje kilka jonów.
Pytanie za 100 punktów jest takie:
Czy taka dysocjacja zachodzi jedno-etapowo ... tzn. czy od razu rozwala się cała
cząsteczka na wszystkie możliwe jony, czy proces taki biegnie w etapach.
Odpowiedzią jest: proces biegnie w etapach .. tzn. po kolei odłączają się jony.
(Dziękuję za oklaski ... wygrałem batonika)
Zobaczmy to na przykładzie kwasu węglowego:
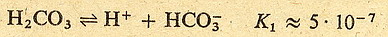
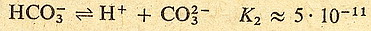
Jak widzisz stała dysocjacji w drugim etapie jest dużo mniejsza niż w pierwszym.
Oznacza to że w roztworze kwasu węglowego znajduje się sporo cząsteczek niezdysocjowanych,
trochę jonów HCO3- i H+ oraz bardzo mało jonów
CO32- (bo drugi etap zachodzi w dużo mniejszym stopniu niż
pierwszy)
W przypadku zasad jest podobnie. Dysocjacja też zachodzi w etapach:
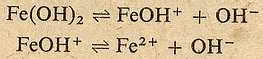
Jak widzisz z powyższych równań widać, że kwas odszczepia w roztworze wodnym
jon wodorowy H+ a zasady jon wodorotlenowy OH-. No i teraz
wiesz już co to znaczy mocny kwas - jest to taki kwas który w znacznym stopniu
ulega dysocjacji, czyli w roztworze wiele jego cząstek rozpada się na jony (czyli
jest dobrym elektrolitem). Słaby kwas to taki, którego niewiele cząstek rozpada
się na jony w roztworze wodnym (słaby elektrolit)
Kwaśny odczyn roztworu wynika właśnie z obecności jonów H+, a odczyn
zasadowy wynika z obecności jonów OH-.
W czystej wodzie (o odczynie obojętnym) tylko niewiele cząsteczek rozpada się
na jony (jedna na 550 milionów)
H2O<-> H+ + OH-
Stała dysocjacji wody wynosi 2*10-16.
Czyli można to zapisać:
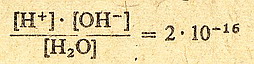 (równanie 1)
(równanie 1)
zajmijmy się tym co jest w mianowniku tego ułamka czyli stężeniem molowym wody
[ H2O ]. Ma ono wartość praktycznie stałą i równą 55,5 mola. Skąd
to się wzięło ... to prostackie ... tak jak pewnie pamiętasz, stężenie molowe
to ilość moli substancji w 1 litrze roztworu. Jeden mol wody waży 18 gramów
(bo tlen waży 16g plus dwa wodory po 1 gram każdy), a litr roztworu wody waży
1000g - to chyba każdy wie
Czyli mamy:
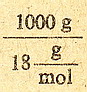 co daje idealnie 55,5 mola - co jest stężeniem molowym czystej wody.
co daje idealnie 55,5 mola - co jest stężeniem molowym czystej wody.
Podstawmy teraz te nasze 55,5 mola do równania 1 i wyjdzie nam:
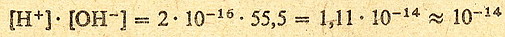 ">
">
No i to co właśnie widzisz przed sobą, czyli iloczyn stężenia jonów wodorowych
i hydroksylowych ([H+]*[OH-]) nazywa się iloczynem jonowym
wody i wynosi 10-14 (w temperaturze
pokojowej, bo im wyższa temperatura tym bardziej on rośnie)
No i tu jest cała zabawa. Dzięki stałej wartości tego iloczynu można określić
odczyn roztworu precyzując stężenie któregokolwiek z jonów wody. W roztworze
kwaśnym stężenie jonów H+ jest duże w roztworze zasadowym duże jest
stężenie jonów OH-.
Tak jak mówiliśmy w czystej wodzie stężenie jonów H+ równa się stężeniu
jonów OH- i wynosi 10-7 czyli (0,0000001)
[ H+] = [ OH-] = 10-7
No dobra ... wkurzające tylko są te potęgi i w dodatku z minusami. Czy nie
można by tego jakoś prościej zapisać???
Odpowiedź brzmi: MOŻNA !
Jako że siedzisz sobie teraz przed komputerkiem to zrobimy, małe ćwiczonko
... uruchom kalkulator .. wejdź w START -> Programy -> Akcesoria ->
Kalkulator. Masz już?? No to gicio ... jedziemy dalej. Z menu Widok wybierz
"Naukowy" ... a co ... nie będziemy się szczypać
Wpisz "10" potem naciśnij klawisz "x^y" (podnieś do potęgi)
teraz wybierz "7" ... ale ... ale .. my chcemy żeby to było do minus
siódmej potęgi więc naciśnij jeszcze "+/-" czyli zmieniamy znak na
ujemny i teraz walnij w "=" to otrzymasz naszą liczbę: 0,0000001
No i teraz spróbujemy tą liczbę jakoś tak przekształcić aby wyglądała ona "po
ludzku" (bez tylu tych cholernych zer)
Więc naciśnij sobie "log" i otrzymasz "-7" a potem zmień
znak za pomocą "+/-" i otrzymasz "7".
Proste ... jak drut ... czyli logarytmując taką liczbę i zmieniając jej znak
otrzymamy niewielką liczbę całkowitą ... i o to nam chodziło.
Więc zamiast pisać że stężenie jonów wodorowych wynosi 0,0000001 to piszemy
że ma pH=7 (co oznacza że liczbę 0,0000001 zlogarytmowaliśmy i zmieniliśmy jej
znak), tak więc pH jest to ujemny logarytm dziesiętny
stężenia jonów H+.
Równie dobrze można wyznaczać stężenie jonów OH- i wtedy mówimy
że wyznaczamy pOH.
Między pH a pOH zachodzi równość:
pH + pOH = 14
Mówimy że roztwory kwaśne to takie których pH jest mniejsze od 7 ... im wyższe
pH tym roztwór bardziej zasadowy ... bo coraz mniej jonów H+.
No i to tyle ... widzisz ... całe te pH i pOH to łatwizna. Jak chcesz to zerknij
jeszcze na zadanka z rozwiązaniami poniżej. Zadania te nadesłała mi Natalka,
co zresztą skłoniło mnie do napisania tej strony
1) Do roztworu elektrolitu dolano wody. Jak zmieniła się wartość stałej i stopnia
dysocjacji?
Stała to stała - jest charakterystyczna dla danych (słabych) elektrolitów i
tu się nie zmienia. Natomiast zmieni się stopień dysocjacji. Rozcieńczyliśmy
roztwór, czyli więcej cząsteczek mogło ulec dysocjacji, czyli stopień dysocjacji
wzrósł.
2) Wartości stałych dysocjacji odpowiednich kwasów są
następujące: kwas mlekowy 1,4*10-4; kwas cyjanowodorowy 7,2*10-10;
kwas octowy 1,8*10-5; kwas podchlorowy 4,3*10-8; kwas
fluorowodorowy 6,7*10-4. Uporządkuj kwasy według wzrastającej kwasowości.
Wiemy że mocne kwasy to te, które dysocjują najmocniej - najwięcej ich cząsteczek
rozpada się na jony - czyli ich stałe dysocjacji są duże. Skoro mamy uporządkować
kwasy według wzrastającej kwasowości to zaczniemy od najsłabszych, czyli tych
z najmniejszymi stałymi dysocjacji. Kolejność będzie taka: kwas cyjanowodorowy
(najsłabszy), kwas podchlorowy, kwas octowy, kwas mlekowy, kwas fluorowodorowy.
3) Oblicz pH w 0,03 molowym roztworze jednoprotonowego
kwasu, którego stopień dysocjacji wynosi 15%.
Mamy jakiś kwas HX który dysocjuje tak:
HX <-> H+ + X-
Załóżmy sobie na razie że jest to 1 molowy kwas (a nie 0,03 molowy) i wiemy
że dysocjuje on w 15% czyli tylko 15 procent jego cząsteczek ulegnie rozpadowi
na jony w roztworze wodnym. Więc mieli byśmy coś takiego:
HX <-> H+ + X-
0,85...0,15...0,15
(czyli stężenie jonów H+ będzie wynosiło 0,15 mola/litr - ale pamiętasz
że to dotyczy założenie że był to kwas 1 molowy)
a my mamy kwas 0,03 molowy - czyli liczymy na krzyż:
1m - 0,15m
0,03m - x
-------------------
x=(0,03 * 0,15) / 1= 0,0045
czytaj to tak: gdyby kwas był 1 molowy to stężenie jonów H+ wynosiło
by 0,15 mola (bo tylko 15% cząsteczek by się rozpadło), a my mamy kwas 0,03 molowy,
czyli stężenie jonów H+ w tym kwasie będzie wynosiło (0,03 * 0,15)
/ 1 co daje nam 0,0045 mola na litr.
Wiesz już że pH to ujemny logarytm ze stężenia jonów wodorowych więc logarytmujemy
nasz wynik i zmieniamy mu znak i otrzymujemy: 2,35 co jest naszym pH roztworu.
HURRA !! Można iść na piwo ... albo na oranżadę ... żebym nie było że namawiam
do złego .. he he he
4) Jakie jest stężenie roztworu amoniaku, w którym pH wynosi 11,7 a K=1,8*10-5.
No to jedziemy, najpierw napiszmy sobie równanie reakcji:
NH3 + H2O <-> NH4+ + OH-
Jak policzyć stężenie amoniaku ... znając stężenie jonów i podstawiając je
do wzoru na stałą dysocjacji obliczymy to o co nam chodzi. Jest tu jednak mały
kruczek. Jak widać w równaniu tym mamy jony OH- a w treści podają
nam informację o pH czyli o stężeniu jonów H+. No i co teraz zrobić??
Ano nic ... wiesz przecież że pH+pOH=14, czyli skoro pH=11,7 to pOH będzie się
w tym wypadku równało 2,3. Pamiętasz, że pOH to jest ujemny logarytm ze stężenia
jonów OH-, czyli stężenie tych jonów będzie wynosiło 0,005 (bo 10-2,3
= 0,005). Mając te informacje podstawiamy je do wzoru na stałą dysocjacji i
mamy:
1,8*10-5 = (0,005 * 0,005)/ stężenie_amoniaku
czyli
stężenie_amoniaku = 1,395 mola
5) Jakie jest stężenie molowe i pH roztworu kwasu octowego, którego stopień
dysocjacji wynosi 12%, a stała dysocjacji K=1,8*10-5.
To jest proste. Skorzystamy tu z prawa rozcieńczeń Ostwalda.
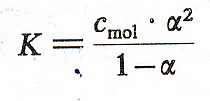
czyli mamy:
1,8 *10-5 = (Cmol * 0,122) / (1 - 0,12) czyli
stężenie molowe roztworu (Cmol) wychodzi nam 0,0011M
OK to uzyskaliśmy odpowiedź na pierwszą część pytania, teraz warto zastanowić
się jakie będzie pH tego roztworu. Napiszmy sobie równanie reakcji:
CH3COOH <-> CH3COO- + H+
wiemy, że stężenie CH3COOH wynosi 0,0011 mola, gdyby dysocjacja (czyli
rozpad na jony) zachodziła w 100% to powstało by 0,0011 mola jonów CH3COO-
i H+, ale my wiemy że dysocjacja zachodzi tylko w 12% więc policzymy
to sobie na krzyż:
0,0011mola - 100%
x - 12%
----------------------------------
x=(0,011 * 12)/100 = 0,000132
czytaj to tak: gdyby dysocjacja zachodziła w 100% to uzyskalibyśmy 0,0011 mola
jonów H+, a gdy dysocjacja zachodzi w 12% to uzyskamy "x"
jonów wodorowych i jak widzisz nasze x (czyli stężenie jonów H+)
wynosi 0,000132. Wiesz już też, że pH to nic innego jak ujemny logarytm ze stężenia
jonów wodorowych. Czyli otrzymany wynik logarytmujesz i zmieniasz znak i otrzymujesz
wartość pH która równa się 3,88 i to jest koniec ... ufff
6. Do 25 cm3 0,1 molowego roztworu kwasu solnego dolano 24 cm3
0,15 molowego roztworu NaOH. Oblicz pH roztworu po zmieszaniu.
To jest dosyć ciekawe zadanko 
Na początku napiszmy sobie równania reakcji, aby w ogóle wiedzieć co tam się
będzie działo:
HCl <-> H+ + Cl-
NaOH <-> Na+ + OH-
Kwas solny jest mocnym kwasem, a zasada sodowa jest mocną zasadą więc założymy
sobie, że zdysocjują (rozpadną się na jony) w 100%. Czyli z kwasu solnego otrzymamy
po 0,1 mola jonów H+ i Cl-. Dobra, ale pamiętasz, że stężenie
molowe odnosi się do 1 litra - czyli 1000 cm3 a my tego kwasu mamy
tylko 25 cm3 więc trzeba to uwzględnić. Znowu liczymy sobie "na
krzyż":
0,1 mola - 1000 cm3
x moli - 25 cm3
-------------------------------
x = (25*0,1) / 1000 = 0,0025
czytaj to tak: gdybyśmy mieli 1000 cm3 roztworu to stężenie jonów
H+ wynosiłoby 0,1 mola. My mamy tylko 25 cm3 a nasze stężenie
jonów H+ w tej objętości wynosi "x". I tak x wyszło nam
0,0025
Podobnie robimy z zasadą sodową. Jej z kolei mamy 0,15 mola w 24 cm3.
0,15 mola - 1000 cm3
x moli - 24 cm3
----------------------------
x = (24*0,15) / 1000 = 0,0036 moli jonów OH-
No i co teraz obliczyliśmy ... obliczyliśmy ile mam naprawdę jonów H+
i OH- w naszym roztworze. Co te jony będą robiły ... ano będą łączyły
się ze sobą dając cząsteczki wody ( bo H+ + OH- daje H2O
) czyli krótko mówiąc zneutralizują się wzajemnie ... ale ... ale ... jednych
jonów trochę zostanie ... i już pewnie wiesz których. Zostanie trochę jonów
OH-. Ile? Dokładnie 0,0011 mola ( bo 0,0036 - 0,0025 = 0,0011 )
Skoro zostanie nam w roztworze trochę jonów OH- to wiemy że pH roztworu
będzie musiało być większe od 7 charakterystyczne dla zasad. OK ... ale jak
to policzyć ... my mamy jony OH- w roztworze a pH odnosi się do stężenia
jonów H+, których tu nie mamy ... i co teraz?
Po wypiciu piwa ... albo oranżady ... przychodzi nam genialny pomysł do
głowy, że możemy przecież policzyć pOH ( ujemny logarytm ze stężenia jonów wodorotlenowych
OH- ), a znając pOH będziemy mogli policzyć pH bo pH + pOH = 14
No to liczymy ... wiemy, że stężenie jonów OH-, które nam zostały
wynosi 0,0011 mola ... ale w jakiej objętości ... w 49 cm3 - bo przecież
wymieszaliśmy dwa roztwory, jeden miał 25 cm3 a drugi 24 cm3.
Pamiętamy że stężenie molowe odnosi się do 1000 cm3 więc znowu genialną
metodą "na krzyż" policzymy sobie jakie byłoby stężenie jonów OH-
gdybyśmy mieli 1000 cm3 a nie 24:
0,0011 mola OH- - 49 cm3
x mola OH- - 1000 cm3
----------------------------------------
x = ( 1000 * 0,0011) / 49 = 0,02249 mola OH-
OK, logarytmujemy nasz wynik i zmieniamy mu znak i otrzymujemy wynik 1,65 ...
czyli nasz pOH = 1,65
Wiemy już, że
pH + pOH = 14 czyli w naszym wypadku:
pH = 14 - 1,65 = 12,35
I to jest END OF SONG ... narka ... pa pa
*** Jacek Seń ***