OK ... każdy, kto kiedyś rozcieńczał alkohol etylowy w celu przeprowadzenia naukowej
analizy smakowej i zarejestrowania wpływów takowego na reakcje psychoruchowe organizmu
- czyli krótko mówiąc robił drinki na imprezie - doskonale wie, że dobre stężenie
to rzecz niebagatelna.
Na wstępie należy odpowiedzieć sobie co to jest to tajemnicze stężenie?
Jest to bardzo proste: stężenie mówi o tym ile jakiegoś składnika jest w roztworze.
No dobra to teraz drugie zasadnicze pytanie: jakie znasz rodzaje stężeń?
No i znowu nic prostszego:
-
stężenie procentowe
może być wyrażone w procentach masowych (czyli ile gramów jakiejś substancji znajduje
się w 100g roztworu)
może być wyrażone w procentach objętościowych (czyli ile centymetrów sześciennych
jakiejś substancji znajduje się w 100cm3 roztworu.
Dobra koniec gadania zobaczmy jak to wszystko działa:
Wyobraź sobie, że masz 80g wody i wrzucasz do niej 20g soli kuchennej (NaCl),
czyli razem cały twój roztwór waży 100 gramów. No i super ... właśnie otrzymałeś
20% roztwór soli kuchennej.
A jak to się stało, że to tak ładnie wyszło ... zobaczmy co matma na to powie:
Cp = ms/mr *100%
(czyli masz Cp - stężenie procentowe, ms - masa substancji,
mr - masa roztworu). Podstawmy to do naszych danych: Cp - to to
co chcemy policzyć, ms - to 20 (tyle mamy soli), mr - to 100 (bo mamy 20g
soli i 80g wody).
Całość wygląda tak:
Cp = 20g/100g *100%
Cp=20%
Prawda, że proste ... jak but
No dobra a co gdy np. będziesz miał 150g wody i 10g soli kuchennej ... ano
nic ... nasz masa substancji to 10g, masa roztworu to 160g (bo 150g wody i
10g soli)
Cp=10g/160g * 100% = 6,25%
To były procenty wagowe - bo wszystko liczyliśmy w gramach. Na ogół jeżeli
mówi się o stężeniu procentowym to na myśli ma się właśnie stężenie wagowe.
-
stężenie molowe
krótkie przypomnienie co to ten Mol:
Mol to jest jakaś liczba. Na pewno znasz już inne określenia na jakieś liczby, np.
tuzin to 12, kopa 60 itd. Mol to 6,02*1023 czyli całkiem sporo.
Dlaczego akurat tyle? Ano dlatego bo tyle właśnie tyle atomów
znajduje się 12g węgla (dokładnie w 12 gramach izotopu węgla 12C)
Dobra, a co to to stężenie molowe ...
znowu prościzna - to ilość moli substancji w 1 litrze roztworu.
Tradycyjnie zobaczmy jak to wszystko wygląda w praktyce:
Wyobraź sobie że masz 58,5 grama soli kuchennej (NaCl) zawartej w 1 dm3 roztworu.
Najpierw sprawdźmy ile to jest moli te 58,5 grama ... więc liczymy ... masa
atomowa sodu (Na) to 23, a masa atomowa chloru (Cl) to 35,5 czyli mamy dokładnie
58,5. Czyli nasze 58,5 grama to jest jeden mol. Czyli stężenie molowe naszego
roztworu wynosi 1mol na decymetr sześcienny. Prawda że proste ...
Dobra a teraz zakładamy, że mamy 100g soli kuchennej zawartej w 1,5 litra
roztworu ... jakie jest stężenie molowe tego roztworu ... prościzna ... wiemy
że mamy 1,5dm3 roztworu ... i w nim jest 100g ... a chcemy wiedzieć
ile gramów soli będzie w 1dm3 (bo stężenia molowe zawsze określa
się w 1dm3 roztworu) . No to policzymy sobie to na krzyż:
100g NaCl - 1,5dm3 roztworu (czytaj:
100g NaCl jest w 1,5 dm3 roztworu)
x g NaCl - 1dm3 roztworu (czytaj:
a ile (x) gramów NaCl jest w 1litrze (dm3) roztworu?)
-------------------------------------------------
wynik otrzymujesz mnożąc 1 * 100 / 1,5 czyli nasze x=66,66
znaczy się wiemy już że w 1 litrze naszego roztworu jest 66,66g soli (NaCl)
No to lecimy dalej ... 1 mol NaCl to 58,5 grama ... czyli nasze 66,66g to
1,14 mola (bo 66,66/58,5 = 1,14)
HURRA!! Mamy nasz wynik. Stężenie molowe takiego roztworu to 1,14 mola na decymetr
sześcienny. Zwróć uwagę że nie potrzebowałeś żadnych wzorów aby to wyliczyć
... ale ponieważ większość nauczycieli lubuje się we wzorach więc dla porządku
podaję takowy wzorek: Cm = m/(M*Vr)
gdzie Cm to nasze stężenie molowe, m - masa substancji, M - masa
molowa substancji, Vr - objętość roztworu podana w decymetrach
sześciennych.
Przeliczanie stężeń
Wprawdzie są tam jakieś wzory na przeliczanie stężeń, ale one są dla kujonów i
nauczycieli. Ja jestem zbyt leniwy aby wkuwać niepotrzebne rzeczy, więc pokażę Ci
jak w PROSTY sposób przeliczać stężenia.
Z molowego na procentowe:
Załóżmy że chcesz przeliczyć stężenie molowe na procentowe ... to też jest
łatwizna. Jedyną rzeczą, którą musisz znać jest gęstość roztworu. Na przykład
chcesz wiedzieć jakie jest stężenie procentowe 1,5 molowego roztworu NaCl. Zakładamy
że gęstość NaCl wynosi
d = 1,04 g/cm3
Dobra ... chcesz uzyskać stężenie procentowe ... czyli ile gramów NaCl znajduje
się w 100g roztworu. Masz roztwór 1,5 molowy. Czyli masz 87,75 grama (bo 58,5
* 1,5 = 87,75 ... a 58,5 to masa jednego mola NaCl) soli w 1000cm3
roztworu.
OK ... teraz musimy sprawdzić ile ten 1000cm3 roztworu waży ...
bo stężenie procentowe to ilość gramów substancji w 100 gramach (a nie centymetrach
sześciennych) roztworu ... no to jedziemy :
Z gęstości wiemy że 1cm3 roztworu waży 1,04g ... czyli 1000cm3
roztworu waży 1040 gramów (1,04 *1000).
No to jesteśmy w domu ... bo wiemy że mamy 87,75 grama soli w 1040 gramach
roztworu ... to teraz pozostaje sprawdzenie ile gramów soli jest w 100 gramach
roztworu:
87,75g NaCl - 1040g roztworu
x gNaCl - 100g roztworu
--------------------------------------------
x=(100*87,75)/1040 = 8,44
No i po strachu ... stężenie procentowe 1,5 molowego roztworu NaCl wynosi 8,44%
(bo 8,44g soli NaCl znajduje się w 100 gramach roztworu)
Z procentowego na molowe:
Wałkujemy dalej nasz NaCl. Załóżmy że chcesz się dowiedzieć jakie jest stężenie
molowe 10% roztworu NaCl. Gęstość roztworu wynosi 1,04g/cm3
Ze stężenia procentowego wiemy że mamy 10g NaCl w 100g roztworu. Ponieważ stężenia
molowe odnoszą się do decymetra sześciennego więc musimy sprawdzić ile waży
ten decymetr sześcienny tego roztworu:
Z gęstości wiemy że 1cm3 roztworu waży 1,04g ... czyli 1000cm3
roztworu waży 1040 gramów (1,04 *1000).
My z kolei mamy 10g soli w 100g roztworu, to teraz musimy sprawdzić ile to
będzie gramów soli w 1040 gramach roztworu:
10g NaCl - 100g roztworu
xg NaCl - 1040g roztworu
----------------------------------------
x = (1040*10)/100 = 104g
Dobra wiemy już że mamy 104 gramy soli NaCl w jednym litrze roztworu. Skoro
jeden mol NaCl to 58,5g NaCl to:
1mol - 58,5g
x moli - 104g
-------------------
x = (104*1) / 58,5 = 1,77 mola
END ... stężenie molowe takiego roztworu wynosi 1,77 mola
Mieszanie roztworów
Ostatnia rzecz, którą się zajmiemy to mieszanie roztworów. Załóżmy że masz
w jednym naczyniu roztwór 96% kwasu siarkowego (H2S04) a w drugim 15% roztwór
takiego kwasu. Pytanie za 5 punktów brzmi w jakim stosunku wagowym należy je
zmieszać aby otrzymać roztwór 50 procentowy.
Zastosujemy tu regułę mieszania:

czyli:
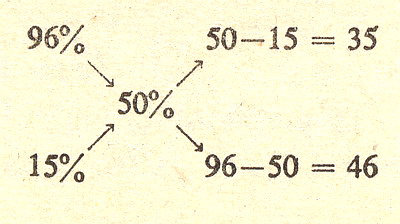
wracając do naszego pytania musiałbyś zmieszać 35 części wagowych (np gramów)
roztworu 96% z 46 częściami wagowymi (np gramami) roztworu 15 procentowego.
W przypadku stężeń molowych zasada jest taka sama tylko należy mieszać nie
części wagowe tylko części objętościowe (np centymetry sześcienne):

No to tyle ... pamiętaj tylko aby zawsze wlewać roztwór
bardziej stężony do mniej stężonego no chyba że chcesz doprowadzić do
małego wybuchu
*** Jacek Seń ***