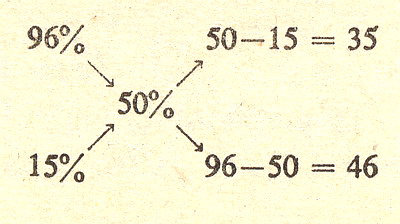26 grudnia 2010
Polska – Słowacja – Węgry – Rumunia – Bułgaria – Turcja – Gruzja – Armenia – Polska
25 grudnia 2010
MySQL – podstawy
mysql> SELECT * FROM Cars INTO OUTFILE '/tmp/cars.csv' -> FIELDS TERMINATED BY ','; http://zetcode.com/databases/mysqltutorial/exportimport/łączenie do MySQL mysql przetargi --host=153.19.105.4 -p sql> grant all privileges on nazwabazy.* to user@localhost identified by "jakieshaslo";
mysql> set character_set_client=latin2;
mysql> set character_set_connection=utf8;
mysql> load data infile "/tmp/przyswajalne" into table strony fields
terminated by ';' LINES TERMINATED BY '\r\n' (nazwa_html,zawartosc);
mysql> CREATE DATABASE akw_baza_test DEFAULT CHARACTER SET utf8 COLLATE
utf8_general_ci;
mysql> create table produkty (nr INT NOT NULL AUTO_INCREMENT, kategoria
VARCHAR(20), jednostka VARCHAR(10), iloscp INT, wstog FLOAT, odchylenie
FLOAT, co VARCHAR(50), rodzaj VARCHAR(50), podrodzaj VARCHAR(50), sklasnik
VARCHAR(60), PRIMARY KEY (nr)) default character set utf8;
mysql> alter table produkty add column skladnik VARCHAR(60);
mysql> load data infile "d:\\jacek\\pierdoly\\trans\\1.csv" into table
produkty character set cp1250 fields terminated by ';' LINES TERMINATED BY
'\r\n' (skladnik, jednostka, iloscp, wstog, odchylenie);
sql> update produkty set kategoria="konserwa" where nr<12;
character_set_client = the character set data from the client is encoded in
character_set_connection = MySQL converts incoming data to. It converts
from character_set_client
character_set_results = MySQL converts outgoing data to
character_set_server = character set for the new database
character_set_database = character set for the new tables
character_set_system = the character set for meta data: database, table,
column names
aby ustawić:
set character_set_results = latin2; (lub utf8, lub iso-8859-2)
show variables like "%char%";
show variables like "%collation%";
aby poprawnie wpisywać z windowsowej konsoli trzeba ustawić:
set character_set_client = cp852;
również aby poprawnie zobaczyć w konsoli jakie są zapisy w kolumnach
trzeba ustawić
set character_set_results = cp852;
aby na stronie WWW wyświetlało się poprawnie należy ustawić:
mysql_query("SET character_set_results=utf8"); lub latin2
tuż przed zadaniem zapytania
mysqldump --user=root --password=haslo --default-character-set=utf8 --opt
-all badania > badania.sql
mysql db_name < backup-file.sql
create table opla_pass (numer int NOT NULL auto_increment, user
varchar(100), haslo varchar(100), ip varchar(30), nazwa_komputera
varchar(40), PRIMARY KEY (numer));
create table skany (porzadkowy int not null auto_increment, numer int,
skan blob, primary key (porzadkowy));
grant select,insert,update,delete on faktury.* to 'fakt'@'localhost'
identified by 'haslo';
alter table skany modify column skan longblob;
alter table skany drop column data_dodania;
logowanie do pliku zewnętrznego:
mysql> tee mysql.out
Logging to file 'mysql.out'
echo "select * from customer;" | mysql {required options} custdb >
customer.txt
mysql> insert into produkty (kategoria, jednostka, iloscp, wstog,
odchylenie, co, rodzaj, podrodzaj, skladnik, medium, coi
d) values ("", "miligramy", "10", "6490.5" , NULL, "szprot w oleju",
"kwasy tłuszczowe", "nasycone", "", "", "2");
/usr/local/mysql/bin/mysqldump --user=root --password=haslo --max_allowed_packet=99M --opt --all spamassassin > spamassassin.sql
24 grudnia 2010
Oracle wprowadzenie (K1)
- Oracle 8 – 1997
- Oracle 8i – 1999
- Oracle 9i – 2001
- Oracle 10g – 2003
- Oracle 11g – 2007
Rodzaje baz danych:
- Oracle Express Edition
1GB RAM, 4 GB Dysk - Oracle Personal Edition
dla developerów. Wymagana licencja. Funkcjonalność SE - Oracle Standard Edition One
do 2 CPU, brak wsparcia dla RAC - Oracle Standard Edition
do 4 CPU na pojedynczym systemie lub klastrze RAC - Oracle Enterprise Edition
ODBC – Open DataBase Connectivity standard.
JDBC – Java DataBase Connectivity open standard.
OCI – Oracle Call Interface – interfejs programistyczny – tworzenie zaawansowanych i wydajnych programów.
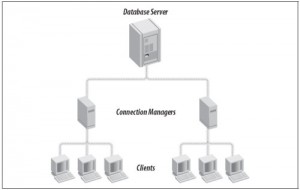
Oracle Internet Directory – OID pozwala na połączenie z serwerem bez plików konfiguracyjnych po stronie klienta. OID jest implementacją LDAP
(Lightweight Directory Access Protocol)
Oracle Connection Manager – CMAN – pozwala na ograniczenie połączeń typu Oracle Net poprzez użycie koncentratorów.
Oracle Application Server
- BPEL Business Process Execution Language (BPEL) – tool is designed for
Service-Oriented Architecture (SOA) environments and used for creating, managing,
and deploying cross-application business processes. - Business Activity Monitoring (BAM)
- WebCenter – portal framework used for deploying portlets and
Ajax-based components.
The Fusion Middleware SOA Suite serves as the basis for Oracle’s Application
Integration Architecture (AIA).
Distributed Queries and Transactions
Distributed queries can retrieve data from multiple databases.
Distributed transactions can insert, update, or delete data on distributed databases.
Oracle’s two-phase commit mechanism.
Transportable Tablespaces
Database Parallelization
Bitmap indexes
Bitmap indexes typically work best for columns that have few different values relative to the overall number of rows in a table.
A bitmap index uses an individual bit for each
potential value with the bit either “on” (set to 1) to indicate that the row contains the
value or “off” (set to 0) to indicate that the row does not contain the value.
OLAP
Online Analytical Processing.
Za wikipedią: Kostka OLAP (ang. OLAP cube) – wielowymiarowa baza danych, która przechowuje dane w sposób bardziej
przypominający wielowymiarowe arkusze kalkulacyjne niż tradycyjną, relacyjną bazę danych. Kostka umożliwia
wyświetlanie i oglądanie danych z różnych punktów widzenia. Do jej budowy potrzeba dowolnego źródła danych
opartego na relacjach. Ze względów wydajnościowych zaleca się stosowanie źródeł opartych na języku SQL i
technologii hurtowni danych.
The OLAP Option physically stores dimensionally aware cubes in the Oracle relational
database. These cubes are most frequently accessed using SQL, although a
22 | Chapter 1: Introducing Oracle
Java API is also supported.
Data Mining Option.
Business intelligence tools.
Database Management Features.
Starting with Oracle Database 10g, statistics are automatically gathered to an Automatic
Workload Repository (AWR) within the database.
Oracle’s Automatic Database
Diagnostic Monitor (ADDM) evaluates the statistics on a regular basis and sends alerts
of potential problem conditions to Oracle Enterprise Manager.
Some of the newer fully automated features, such as Automatic Memory Management, also leverage
data gathered in the AWR.
Oracle Enterprise Manager.
EM provides a database management tool framework and an
HTML-based interface used to manage database users, instances, and features. EM
can also manage Oracle Application Server, Oracle Applications, Oracle’s Linux
release, and software products from other vendors.
Data Guard.
The standby database
provides a copy of the production database to be used if the primary database is lost.
Oracle Real Application Clusters.
Cache Fusion that greatly minimizes the amount of writing to disk
that was formerly used to control data locks.
Oracle Database 10g introduced a new
level of RAC portability and Oracle support by providing integrated “clusterware”
for the supported RAC platforms.
Applications can leverage the Oracle Call Interface (OCI) to provide failover to a
second instance transparently to the user.
Automated Storage Management.
Oracle Portal.
Servlety to technologia skryptów Java wykonywanych po stronie serwera.
Portlet jest to niezależny komponent stworzony najczęściej w języku Java do umieszczenia
na stronie www. Są to programy wyświetlające jedną funkcjonalność na stronie. Portlet jest
umieszczany w kontenerze portletów, który agreguje zawartość prezentowanej strony.
Celem portletów jest stworzenie programu, który będzie uniezależniony od kontenera,
na którym będzie uruchamiany, co stwarza możliwość jego wielokrotnego użycia.
Oracle TimesTen.
Oracle TimesTen is a relational database that is stored in physical memory and is
typically used where very high-performance transaction-processing workloads are
present.
MySQL – zwiększenie rozmiaru bazy danych
mysql> show engines; mysql> show table status; aby dodać miejsce (INNODB) trzeba zamknąć bazę: mysqladmin -u root -p shutdown a następnie w /etc/my.cnf trzeba dodać kolejny plik innodb_data_file_path = dbdata1:200M;dbdata2:200M;dbdata3:512M i uruchomić bazę ponownie.
Przeliczanie stężeń.
OK ... każdy, kto kiedyś rozcieńczał alkohol etylowy w celu przeprowadzenia naukowej analizy smakowej i zarejestrowania wpływów takowego na reakcje psychoruchowe organizmu - czyli krótko mówiąc robił drinki na imprezie - doskonale wie, że dobre stężenie to rzecz niebagatelna.
Na wstępie należy odpowiedzieć sobie co to jest to tajemnicze stężenie? Jest to bardzo proste: stężenie mówi o tym ile jakiegoś składnika jest w roztworze. No dobra to teraz drugie zasadnicze pytanie: jakie znasz rodzaje stężeń?
No i znowu nic prostszego:
-
stężenie procentowe może być wyrażone w procentach masowych (czyli ile gramów jakiejś substancji znajduje się w 100g roztworu)może być wyrażone w procentach objętościowych (czyli ile centymetrów sześciennych jakiejś substancji znajduje się w 100cm3 roztworu.Dobra koniec gadania zobaczmy jak to wszystko działa:
Wyobraź sobie, że masz 80g wody i wrzucasz do niej 20g soli kuchennej (NaCl), czyli razem cały twój roztwór waży 100 gramów. No i super ... właśnie otrzymałeś 20% roztwór soli kuchennej.
A jak to się stało, że to tak ładnie wyszło ... zobaczmy co matma na to powie:
Cp = ms/mr *100%(czyli masz Cp - stężenie procentowe, ms - masa substancji, mr - masa roztworu). Podstawmy to do naszych danych: Cp - to to co chcemy policzyć, ms - to 20 (tyle mamy soli), mr - to 100 (bo mamy 20g soli i 80g wody).
Całość wygląda tak:
Cp = 20g/100g *100%Cp=20%Prawda, że proste ... jak but
No dobra a co gdy np. będziesz miał 150g wody i 10g soli kuchennej ... ano nic ... nasz masa substancji to 10g, masa roztworu to 160g (bo 150g wody i 10g soli)
Cp=10g/160g * 100% = 6,25%To były procenty wagowe - bo wszystko liczyliśmy w gramach. Na ogół jeżeli mówi się o stężeniu procentowym to na myśli ma się właśnie stężenie wagowe.
-
stężenie molowe krótkie przypomnienie co to ten Mol:Mol to jest jakaś liczba. Na pewno znasz już inne określenia na jakieś liczby, np. tuzin to 12, kopa 60 itd. Mol to 6,02*1023 czyli całkiem sporo. Dlaczego akurat tyle? Ano dlatego bo tyle właśnie tyle atomów znajduje się 12g węgla (dokładnie w 12 gramach izotopu węgla 12C) Dobra, a co to to stężenie molowe ... znowu prościzna - to ilość moli substancji w 1 litrze roztworu.Tradycyjnie zobaczmy jak to wszystko wygląda w praktyce:
Wyobraź sobie że masz 58,5 grama soli kuchennej (NaCl) zawartej w 1 dm3 roztworu. Najpierw sprawdźmy ile to jest moli te 58,5 grama ... więc liczymy ... masa atomowa sodu (Na) to 23, a masa atomowa chloru (Cl) to 35,5 czyli mamy dokładnie 58,5. Czyli nasze 58,5 grama to jest jeden mol. Czyli stężenie molowe naszego roztworu wynosi 1mol na decymetr sześcienny. Prawda że proste ...
Dobra a teraz zakładamy, że mamy 100g soli kuchennej zawartej w 1,5 litra roztworu ... jakie jest stężenie molowe tego roztworu ... prościzna ... wiemy że mamy 1,5dm3 roztworu ... i w nim jest 100g ... a chcemy wiedzieć ile gramów soli będzie w 1dm3 (bo stężenia molowe zawsze określa się w 1dm3 roztworu) . No to policzymy sobie to na krzyż:
100g NaCl - 1,5dm3 roztworu (czytaj: 100g NaCl jest w 1,5 dm3 roztworu)x g NaCl - 1dm3 roztworu (czytaj: a ile (x) gramów NaCl jest w 1litrze (dm3) roztworu?)-------------------------------------------------
wynik otrzymujesz mnożąc 1 * 100 / 1,5 czyli nasze x=66,66znaczy się wiemy już że w 1 litrze naszego roztworu jest 66,66g soli (NaCl)
No to lecimy dalej ... 1 mol NaCl to 58,5 grama ... czyli nasze 66,66g to 1,14 mola (bo 66,66/58,5 = 1,14)
HURRA!! Mamy nasz wynik. Stężenie molowe takiego roztworu to 1,14 mola na decymetr sześcienny. Zwróć uwagę że nie potrzebowałeś żadnych wzorów aby to wyliczyć ... ale ponieważ większość nauczycieli lubuje się we wzorach więc dla porządku podaję takowy wzorek: Cm = m/(M*Vr) gdzie Cm to nasze stężenie molowe, m - masa substancji, M - masa molowa substancji, Vr - objętość roztworu podana w decymetrach sześciennych.
Przeliczanie stężeń
Wprawdzie są tam jakieś wzory na przeliczanie stężeń, ale one są dla kujonów i
nauczycieli. Ja jestem zbyt leniwy aby wkuwać niepotrzebne rzeczy, więc pokażę Ci
jak w PROSTY sposób przeliczać stężenia.
Z molowego na procentowe:
Załóżmy że chcesz przeliczyć stężenie molowe na procentowe ... to też jest łatwizna. Jedyną rzeczą, którą musisz znać jest gęstość roztworu. Na przykład chcesz wiedzieć jakie jest stężenie procentowe 1,5 molowego roztworu NaCl. Zakładamy że gęstość NaCl wynosi
d = 1,04 g/cm3
Dobra ... chcesz uzyskać stężenie procentowe ... czyli ile gramów NaCl znajduje się w 100g roztworu. Masz roztwór 1,5 molowy. Czyli masz 87,75 grama (bo 58,5 * 1,5 = 87,75 ... a 58,5 to masa jednego mola NaCl) soli w 1000cm3 roztworu.
OK ... teraz musimy sprawdzić ile ten 1000cm3 roztworu waży ... bo stężenie procentowe to ilość gramów substancji w 100 gramach (a nie centymetrach sześciennych) roztworu ... no to jedziemy :
Z gęstości wiemy że 1cm3 roztworu waży 1,04g ... czyli 1000cm3 roztworu waży 1040 gramów (1,04 *1000).
No to jesteśmy w domu ... bo wiemy że mamy 87,75 grama soli w 1040 gramach roztworu ... to teraz pozostaje sprawdzenie ile gramów soli jest w 100 gramach roztworu:
87,75g NaCl - 1040g roztworu
x gNaCl - 100g roztworu
--------------------------------------------
x=(100*87,75)/1040 = 8,44
No i po strachu ... stężenie procentowe 1,5 molowego roztworu NaCl wynosi 8,44% (bo 8,44g soli NaCl znajduje się w 100 gramach roztworu)
Z procentowego na molowe:
Wałkujemy dalej nasz NaCl. Załóżmy że chcesz się dowiedzieć jakie jest stężenie molowe 10% roztworu NaCl. Gęstość roztworu wynosi 1,04g/cm3
Ze stężenia procentowego wiemy że mamy 10g NaCl w 100g roztworu. Ponieważ stężenia molowe odnoszą się do decymetra sześciennego więc musimy sprawdzić ile waży ten decymetr sześcienny tego roztworu:
Z gęstości wiemy że 1cm3 roztworu waży 1,04g ... czyli 1000cm3 roztworu waży 1040 gramów (1,04 *1000).
My z kolei mamy 10g soli w 100g roztworu, to teraz musimy sprawdzić ile to będzie gramów soli w 1040 gramach roztworu:
10g NaCl - 100g roztworu
xg NaCl - 1040g roztworu
----------------------------------------
x = (1040*10)/100 = 104g
Dobra wiemy już że mamy 104 gramy soli NaCl w jednym litrze roztworu. Skoro jeden mol NaCl to 58,5g NaCl to:
1mol - 58,5g
x moli - 104g
-------------------
x = (104*1) / 58,5 = 1,77 mola
END ... stężenie molowe takiego roztworu wynosi 1,77 mola
Mieszanie roztworów
Ostatnia rzecz, którą się zajmiemy to mieszanie roztworów. Załóżmy że masz w jednym naczyniu roztwór 96% kwasu siarkowego (H2S04) a w drugim 15% roztwór takiego kwasu. Pytanie za 5 punktów brzmi w jakim stosunku wagowym należy je zmieszać aby otrzymać roztwór 50 procentowy.
Zastosujemy tu regułę mieszania:
czyli:
wracając do naszego pytania musiałbyś zmieszać 35 części wagowych (np gramów) roztworu 96% z 46 częściami wagowymi (np gramami) roztworu 15 procentowego.
W przypadku stężeń molowych zasada jest taka sama tylko należy mieszać nie części wagowe tylko części objętościowe (np centymetry sześcienne):
No to tyle ... pamiętaj tylko aby zawsze wlewać roztwór
bardziej stężony do mniej stężonego no chyba że chcesz doprowadzić do
małego wybuchu
*** Jacek Seń ***
Obliczająć pH unikniesz pecha …
Dobra ... po kiego grzyba komuś jakieś tam pH ... chyba tylko po to, aby pognębić spokojnych ludzi, którzy w tym czasie mogliby robić milion innych ciekawszych rzeczy niż wkuwać chemię, np. trochę zabalować.
Nie jest to jednak do końca prawda ... pH nie jest takie głupie, jak na pierwszy rzut oka wygląda, a jego znajomość przydaje się w wielu sytuacjach ... na przykład, gdy już posiądziesz tą magiczną umiejętność obliczania tajemniczego pH, to będziesz mógł się nią podzielić z jakąś miłą koleżanką (lub kolegą) ... z którą później będziesz mógł się umówić na jakąś imprezkę ... he he he ... tak czy owak, jak widzisz wszystko prowadzi do dobrej zabawy.
No to wystarczy tego chachmęcenia, sprawdźmy o co w tym wszystkim chodzi???
A teraz ZAPOMNIJ o tym wszystkim o czym uczyli Cię do tej pory o pH ... pewnie gadali coś o logarytmach i to w dodatku ujemnych ... aż dreszcze człowieka przechodzą jak słyszy się takie pogańskie nazwy ... zresztą zaraz sam(a) zobaczysz, że nie jest to wcale trudne !!
Zaczynamy bajkę ... w 1887 roku, za siedmioma górami, za siedmioma lasami żył sobie pan, który nazywał się Svante Arrhenius. Svante był dosyć dociekliwym człowiekiem i któregoś dnia zauważył, że niektóre związki chemiczne podczas rozpuszczania w wodzie ulegają rozpadowi na kationy (czyli atomy obdarzone ładunkiem dodatnim) i aniony (atomy obdarzone ładunkiem ujemnym).
Zjawisko to nosi nazwę dysocjacji elektrolitycznej (lub
dysocjacji jonowej)
Te związki chemiczne, które rozpadły się na jony pod wpływem wody nazywa się
elektrolitami.
Zobacz na rysunek poniżej:
Widać tutaj cząsteczkę HCl otoczoną cząsteczkami wody. Te plusiki i minusiki oznaczają, że cząsteczki te mają określone ładunki na swoich końcach. Takie cząsteczki z ładunkami nazywa się cząsteczkami polarnymi albo (dipolami - bo są di (dwu) polarne (biegunowe)).
No i taka biedna cząsteczka HCl otoczona przez te cząsteczki wody ulega rozerwaniu na jony: H+ i Cl-.
Taką reakcję dysocjacji przedstawia się równaniem: HCl -> H+ + Cl-
Ważne jest abyś zapamiętał(a), że jeżeli roztwór zawiera kationy to zawiera i aniony, tak aby wypadkowy ładunek całego roztworu wynosił 0.
Często jest tak, że nie wszystkie cząsteczki wprowadzone do wody rozpadają się na jony. Zostaje pewna liczba cząsteczek, które się nie rozpadły na jony (niezdysocjowanych). Po pewnym czasie między jonami a cząsteczkami niezdysocjowanymi wytwarza się stan równowagi. Mówi się, że jest to równowaga dynamiczna, co oznacza tylko tyle, że w stanie równowagi cząsteczki niezdysocjowane rozpadają się dalej, ale w tym samym czasie jony łączą się w cząsteczki tak więc ani jednych ani drugich już nie przybywa ani nie ubywa.
Dobra ... a teraz warto by jakoś określić ten stan równowagi liczbowo, aby można było to potem wykorzystać.
Służy do tego stała dysocjacji. Zobacz na to równanie:
(tutaj na konkretnym przykładzie CH3COONa)
Jak widać jest to po prostu stosunek iloczynu stężeń jonów do stężenia cząsteczek
niezdysocjowanych w stanie równowagi roztworu. Prostackie ... prawda. Stała dysocjacji jest charakterystyczną właściwością danego elektrolitu
i nie zależy od stężenia.
Patrząc na to równanie powyżej wiadomo że im większa stała dysocjacji tym łatwiej zachodzi proces rozpadania na jony.
Dobra, aby jakoś ilościowo określić całą sprawę warto by znać ilość cząsteczek
które uległy zdysocjowaniu do całkowitej ilości cząsteczek rozpuszczonych w
roztworze. Jest to nic innego jak stopień dysocjacji.
Wypada teraz powiedzieć słówko o zależności między stopniem dysocjacji a stałą
dysocjacji. Zależność tą definiuje prawo rozcieńczeń Ostwalda
i warto o nim pamiętać, bo znacznie ułatwia życie ... zwłaszcza przy rozwiązywaniu
niektórych zadań.
Proste jak drut ... zróbmy teraz mały przykładzik. Jeżeli w 1 litrze roztworu znajduje się 1 mol związku AB, którego stopień dysocjacji wynosi 30%, to oznacza że 30% cząsteczek związku AB rozpadnie się na A+ i B- (czyli będzie to 0,3 mola), a 70% cząsteczek (0,7 mola) AB pozostanie nienaruszonych.
CZYLI ... stężenie molowe elektrolitu (czyli liczba moli wszystkich cząsteczek zdysocjowanych i niezdysocjowanych wynosi 1 mol)
... stężenie molowe niezdysocjowanego elektrolitu wynosi 0,7 mola ....
... stężenie molowe jonów A+ jaki i B- wynosi 0,3 mola, ponieważ z każdej cząsteczki powstaje jeden jon A+ i jeden jon B-.
Stopień dysocjacji zależy od
-) stężenia roztworu (wzrasta w miarę rozcieńczania - bo im bardziej rozcieńczasz tym więcej cząsteczek się rozpada)
-) temperatury (wzrasta ze wzrostem temperatury - bo cząsteczkom łatwiej się rozpadać w wyższej temperaturze - to chyba jasne)
Dobra teraz dwa słowa o podziale elektrolitów:
Jeżeli cząsteczki elektrolitu rozpadają się na jeden kation i jeden anion to są
to elektrolity binarne:
Jeżeli cząsteczki elektrolitu rozpadają się na różne ilości kationów i anionów
to są to elektrolity niebinarne.
Jak widzisz w elektrolitach niebinarnych z jednej cząsteczki powstaje kilka jonów. Pytanie za 100 punktów jest takie:
Czy taka dysocjacja zachodzi jedno-etapowo ... tzn. czy od razu rozwala się cała cząsteczka na wszystkie możliwe jony, czy proces taki biegnie w etapach.
Odpowiedzią jest: proces biegnie w etapach .. tzn. po kolei odłączają się jony. (Dziękuję za oklaski ... wygrałem batonika)
Zobaczmy to na przykładzie kwasu węglowego:
Jak widzisz stała dysocjacji w drugim etapie jest dużo mniejsza niż w pierwszym. Oznacza to że w roztworze kwasu węglowego znajduje się sporo cząsteczek niezdysocjowanych, trochę jonów HCO3- i H+ oraz bardzo mało jonów CO32- (bo drugi etap zachodzi w dużo mniejszym stopniu niż pierwszy)
W przypadku zasad jest podobnie. Dysocjacja też zachodzi w etapach:
Jak widzisz z powyższych równań widać, że kwas odszczepia w roztworze wodnym jon wodorowy H+ a zasady jon wodorotlenowy OH-. No i teraz wiesz już co to znaczy mocny kwas - jest to taki kwas który w znacznym stopniu ulega dysocjacji, czyli w roztworze wiele jego cząstek rozpada się na jony (czyli jest dobrym elektrolitem). Słaby kwas to taki, którego niewiele cząstek rozpada się na jony w roztworze wodnym (słaby elektrolit)
Kwaśny odczyn roztworu wynika właśnie z obecności jonów H+, a odczyn zasadowy wynika z obecności jonów OH-.
W czystej wodzie (o odczynie obojętnym) tylko niewiele cząsteczek rozpada się na jony (jedna na 550 milionów) H2O<-> H+ + OH-
Stała dysocjacji wody wynosi 2*10-16.
Czyli można to zapisać:(równanie 1)
zajmijmy się tym co jest w mianowniku tego ułamka czyli stężeniem molowym wody [ H2O ]. Ma ono wartość praktycznie stałą i równą 55,5 mola. Skąd to się wzięło ... to prostackie ... tak jak pewnie pamiętasz, stężenie molowe to ilość moli substancji w 1 litrze roztworu. Jeden mol wody waży 18 gramów (bo tlen waży 16g plus dwa wodory po 1 gram każdy), a litr roztworu wody waży 1000g - to chyba każdy wie
Czyli mamy:
co daje idealnie 55,5 mola - co jest stężeniem molowym czystej wody.
Podstawmy teraz te nasze 55,5 mola do równania 1 i wyjdzie nam:
">
No i to co właśnie widzisz przed sobą, czyli iloczyn stężenia jonów wodorowych
i hydroksylowych ([H+]*[OH-]) nazywa się iloczynem jonowym
wody i wynosi 10-14 (w temperaturze
pokojowej, bo im wyższa temperatura tym bardziej on rośnie)
No i tu jest cała zabawa. Dzięki stałej wartości tego iloczynu można określić odczyn roztworu precyzując stężenie któregokolwiek z jonów wody. W roztworze kwaśnym stężenie jonów H+ jest duże w roztworze zasadowym duże jest stężenie jonów OH-.
Tak jak mówiliśmy w czystej wodzie stężenie jonów H+ równa się stężeniu jonów OH- i wynosi 10-7 czyli (0,0000001) [ H+] = [ OH-] = 10-7
No dobra ... wkurzające tylko są te potęgi i w dodatku z minusami. Czy nie można by tego jakoś prościej zapisać???
Odpowiedź brzmi: MOŻNA !
Jako że siedzisz sobie teraz przed komputerkiem to zrobimy, małe ćwiczonko ... uruchom kalkulator .. wejdź w START -> Programy -> Akcesoria -> Kalkulator. Masz już?? No to gicio ... jedziemy dalej. Z menu Widok wybierz "Naukowy" ... a co ... nie będziemy się szczypać
Wpisz "10" potem naciśnij klawisz "x^y" (podnieś do potęgi) teraz wybierz "7" ... ale ... ale .. my chcemy żeby to było do minus siódmej potęgi więc naciśnij jeszcze "+/-" czyli zmieniamy znak na ujemny i teraz walnij w "=" to otrzymasz naszą liczbę: 0,0000001
No i teraz spróbujemy tą liczbę jakoś tak przekształcić aby wyglądała ona "po ludzku" (bez tylu tych cholernych zer)
Więc naciśnij sobie "log" i otrzymasz "-7" a potem zmień znak za pomocą "+/-" i otrzymasz "7".
Proste ... jak drut ... czyli logarytmując taką liczbę i zmieniając jej znak otrzymamy niewielką liczbę całkowitą ... i o to nam chodziło.
Więc zamiast pisać że stężenie jonów wodorowych wynosi 0,0000001 to piszemy
że ma pH=7 (co oznacza że liczbę 0,0000001 zlogarytmowaliśmy i zmieniliśmy jej
znak), tak więc pH jest to ujemny logarytm dziesiętny
stężenia jonów H+.
Równie dobrze można wyznaczać stężenie jonów OH- i wtedy mówimy że wyznaczamy pOH.
Między pH a pOH zachodzi równość: pH + pOH = 14
Mówimy że roztwory kwaśne to takie których pH jest mniejsze od 7 ... im wyższe pH tym roztwór bardziej zasadowy ... bo coraz mniej jonów H+.
No i to tyle ... widzisz ... całe te pH i pOH to łatwizna. Jak chcesz to zerknij jeszcze na zadanka z rozwiązaniami poniżej. Zadania te nadesłała mi Natalka, co zresztą skłoniło mnie do napisania tej strony
1) Do roztworu elektrolitu dolano wody. Jak zmieniła się wartość stałej i stopnia
dysocjacji?
Stała to stała - jest charakterystyczna dla danych (słabych) elektrolitów i
tu się nie zmienia. Natomiast zmieni się stopień dysocjacji. Rozcieńczyliśmy
roztwór, czyli więcej cząsteczek mogło ulec dysocjacji, czyli stopień dysocjacji
wzrósł.
2) Wartości stałych dysocjacji odpowiednich kwasów są
następujące: kwas mlekowy 1,4*10-4; kwas cyjanowodorowy 7,2*10-10;
kwas octowy 1,8*10-5; kwas podchlorowy 4,3*10-8; kwas
fluorowodorowy 6,7*10-4. Uporządkuj kwasy według wzrastającej kwasowości.
Wiemy że mocne kwasy to te, które dysocjują najmocniej - najwięcej ich cząsteczek
rozpada się na jony - czyli ich stałe dysocjacji są duże. Skoro mamy uporządkować
kwasy według wzrastającej kwasowości to zaczniemy od najsłabszych, czyli tych
z najmniejszymi stałymi dysocjacji. Kolejność będzie taka: kwas cyjanowodorowy
(najsłabszy), kwas podchlorowy, kwas octowy, kwas mlekowy, kwas fluorowodorowy.
3) Oblicz pH w 0,03 molowym roztworze jednoprotonowego
kwasu, którego stopień dysocjacji wynosi 15%.
Mamy jakiś kwas HX który dysocjuje tak:
HX <-> H+ + X-
Załóżmy sobie na razie że jest to 1 molowy kwas (a nie 0,03 molowy) i wiemy
że dysocjuje on w 15% czyli tylko 15 procent jego cząsteczek ulegnie rozpadowi
na jony w roztworze wodnym. Więc mieli byśmy coś takiego:
HX <-> H+ + X-
0,85...0,15...0,15
(czyli stężenie jonów H+ będzie wynosiło 0,15 mola/litr - ale pamiętasz że to dotyczy założenie że był to kwas 1 molowy)
a my mamy kwas 0,03 molowy - czyli liczymy na krzyż:
1m - 0,15m
0,03m - x
-------------------
x=(0,03 * 0,15) / 1= 0,0045
czytaj to tak: gdyby kwas był 1 molowy to stężenie jonów H+ wynosiło by 0,15 mola (bo tylko 15% cząsteczek by się rozpadło), a my mamy kwas 0,03 molowy, czyli stężenie jonów H+ w tym kwasie będzie wynosiło (0,03 * 0,15) / 1 co daje nam 0,0045 mola na litr.
Wiesz już że pH to ujemny logarytm ze stężenia jonów wodorowych więc logarytmujemy nasz wynik i zmieniamy mu znak i otrzymujemy: 2,35 co jest naszym pH roztworu. HURRA !! Można iść na piwo ... albo na oranżadę ... żebym nie było że namawiam do złego .. he he he
4) Jakie jest stężenie roztworu amoniaku, w którym pH wynosi 11,7 a K=1,8*10-5.
No to jedziemy, najpierw napiszmy sobie równanie reakcji:
NH3 + H2O <-> NH4+ + OH-
Jak policzyć stężenie amoniaku ... znając stężenie jonów i podstawiając je
do wzoru na stałą dysocjacji obliczymy to o co nam chodzi. Jest tu jednak mały
kruczek. Jak widać w równaniu tym mamy jony OH- a w treści podają
nam informację o pH czyli o stężeniu jonów H+. No i co teraz zrobić??
Ano nic ... wiesz przecież że pH+pOH=14, czyli skoro pH=11,7 to pOH będzie się
w tym wypadku równało 2,3. Pamiętasz, że pOH to jest ujemny logarytm ze stężenia
jonów OH-, czyli stężenie tych jonów będzie wynosiło 0,005 (bo 10-2,3
= 0,005). Mając te informacje podstawiamy je do wzoru na stałą dysocjacji i
mamy:
1,8*10-5 = (0,005 * 0,005)/ stężenie_amoniaku
czyli
stężenie_amoniaku = 1,395 mola
5) Jakie jest stężenie molowe i pH roztworu kwasu octowego, którego stopień
dysocjacji wynosi 12%, a stała dysocjacji K=1,8*10-5.
To jest proste. Skorzystamy tu z prawa rozcieńczeń Ostwalda.
czyli mamy:
1,8 *10-5 = (Cmol * 0,122) / (1 - 0,12) czyli stężenie molowe roztworu (Cmol) wychodzi nam 0,0011M
OK to uzyskaliśmy odpowiedź na pierwszą część pytania, teraz warto zastanowić
się jakie będzie pH tego roztworu. Napiszmy sobie równanie reakcji:
CH3COOH <-> CH3COO- + H+
wiemy, że stężenie CH3COOH wynosi 0,0011 mola, gdyby dysocjacja (czyli rozpad na jony) zachodziła w 100% to powstało by 0,0011 mola jonów CH3COO- i H+, ale my wiemy że dysocjacja zachodzi tylko w 12% więc policzymy to sobie na krzyż:
0,0011mola - 100%
x - 12%
----------------------------------
x=(0,011 * 12)/100 = 0,000132
czytaj to tak: gdyby dysocjacja zachodziła w 100% to uzyskalibyśmy 0,0011 mola jonów H+, a gdy dysocjacja zachodzi w 12% to uzyskamy "x" jonów wodorowych i jak widzisz nasze x (czyli stężenie jonów H+) wynosi 0,000132. Wiesz już też, że pH to nic innego jak ujemny logarytm ze stężenia jonów wodorowych. Czyli otrzymany wynik logarytmujesz i zmieniasz znak i otrzymujesz wartość pH która równa się 3,88 i to jest koniec ... ufff
6. Do 25 cm3 0,1 molowego roztworu kwasu solnego dolano 24 cm3
0,15 molowego roztworu NaOH. Oblicz pH roztworu po zmieszaniu.
To jest dosyć ciekawe zadanko 
Na początku napiszmy sobie równania reakcji, aby w ogóle wiedzieć co tam się
będzie działo:
HCl <-> H+ + Cl-
NaOH <-> Na+ + OH-
Kwas solny jest mocnym kwasem, a zasada sodowa jest mocną zasadą więc założymy sobie, że zdysocjują (rozpadną się na jony) w 100%. Czyli z kwasu solnego otrzymamy po 0,1 mola jonów H+ i Cl-. Dobra, ale pamiętasz, że stężenie molowe odnosi się do 1 litra - czyli 1000 cm3 a my tego kwasu mamy tylko 25 cm3 więc trzeba to uwzględnić. Znowu liczymy sobie "na krzyż":
0,1 mola - 1000 cm3
x moli - 25 cm3
-------------------------------
x = (25*0,1) / 1000 = 0,0025
czytaj to tak: gdybyśmy mieli 1000 cm3 roztworu to stężenie jonów H+ wynosiłoby 0,1 mola. My mamy tylko 25 cm3 a nasze stężenie jonów H+ w tej objętości wynosi "x". I tak x wyszło nam 0,0025
Podobnie robimy z zasadą sodową. Jej z kolei mamy 0,15 mola w 24 cm3.
0,15 mola - 1000 cm3
x moli - 24 cm3
----------------------------
x = (24*0,15) / 1000 = 0,0036 moli jonów OH-
No i co teraz obliczyliśmy ... obliczyliśmy ile mam naprawdę jonów H+ i OH- w naszym roztworze. Co te jony będą robiły ... ano będą łączyły się ze sobą dając cząsteczki wody ( bo H+ + OH- daje H2O ) czyli krótko mówiąc zneutralizują się wzajemnie ... ale ... ale ... jednych jonów trochę zostanie ... i już pewnie wiesz których. Zostanie trochę jonów OH-. Ile? Dokładnie 0,0011 mola ( bo 0,0036 - 0,0025 = 0,0011 )
Skoro zostanie nam w roztworze trochę jonów OH- to wiemy że pH roztworu
będzie musiało być większe od 7 charakterystyczne dla zasad. OK ... ale jak
to policzyć ... my mamy jony OH- w roztworze a pH odnosi się do stężenia
jonów H+, których tu nie mamy ... i co teraz?
Po wypiciu piwa ... albo oranżady ... przychodzi nam genialny pomysł do głowy, że możemy przecież policzyć pOH ( ujemny logarytm ze stężenia jonów wodorotlenowych OH- ), a znając pOH będziemy mogli policzyć pH bo pH + pOH = 14
No to liczymy ... wiemy, że stężenie jonów OH-, które nam zostały wynosi 0,0011 mola ... ale w jakiej objętości ... w 49 cm3 - bo przecież wymieszaliśmy dwa roztwory, jeden miał 25 cm3 a drugi 24 cm3. Pamiętamy że stężenie molowe odnosi się do 1000 cm3 więc znowu genialną metodą "na krzyż" policzymy sobie jakie byłoby stężenie jonów OH- gdybyśmy mieli 1000 cm3 a nie 24:
0,0011 mola OH- - 49 cm3
x mola OH- - 1000 cm3
----------------------------------------
x = ( 1000 * 0,0011) / 49 = 0,02249 mola OH-
OK, logarytmujemy nasz wynik i zmieniamy mu znak i otrzymujemy wynik 1,65 ... czyli nasz pOH = 1,65
Wiemy już, że
pH + pOH = 14 czyli w naszym wypadku:
pH = 14 - 1,65 = 12,35
I to jest END OF SONG ... narka ... pa pa
*** Jacek Seń ***
23 grudnia 2010
Serwer DHCP dla dwóch vlan’ów
Tutaj materiały z sieci: serwer_dhcp_dla_dwóch_vlanów.
Cisco – konfiguracja portów …
## aby przypisać port do vlanu show interfaces gigabitethernet 0/17 enable configure terminal interface gigabitethernet 0/17 switchport mode access switchport access vlan 1 end show interfaces gigabitethernet 0/17 switchport ## aby zobaczyć/zmianić access listy dla danego vlanu show ip interface lub dla danego vlanu: show ip interface vlan 1
#### show mac access-group show running-config show ip access-lists show ip access-lists 120 (wyświetlenie wybranej access listy) show ip interface vlan 1 (aby zobaczyć access-listy przypisane do vlanów) show ip interface gigabitethernet0/16 przykłady: config terminal access-list 120 permit tcp host 192.168.0.73 host 192.168.0.72 access-list 120 permit icmp host 192.168.0.73 host 192.168.0.72 access-list 120 permit icmp host 192.168.0.72 host 192.168.0.73 access-list 120 permit udp host 192.168.0.72 host 192.168.0.73 access-list 120 permit ip host 192.168.0.72 host 192.168.0.73 config terminal no access-list 120 permit tcp host 192.168.0.73 host 192.168.0.72 (wykasowanie reguły z access listy) config terminal no access-list 120 (wykasowanie access-listy) przypisanie access-listy do interfejsu 11 interface gigabitethernet0/11 ip access-group 120 in przypisanie access-listy do vlanu 5 configure terminal interface vlan 5 ip access-group 112 in zdjęcie przypisania access-listy do vlanu 5 configure terminal interface vlan 5 no ip access-group 112 in no ip access-group 103 out interface gigabitethernet0/11 no ip access-group no in na porcie hosta 192.168.0.73 aby odpingowywal na pingi z hosta 192.168.0.72 należy: access-list 120 permit icmp host 192.168.0.73 host 192.168.0.72 (dla portu podłączenie 192.168.0.73) na hoście 192.168.0.72 aby można było podłączyć udział z hosta 192.168.0.73: access-list 120 permit tcp host 192.168.0.73 host 192.168.0.72 (dla portu podłączenie 192.168.0.73) przypisanie vlanu do portu Trunk: switchport trunk native vlan 1005
copy running-config startup-config rw (zapisanie konfiguracji)
Przypisanie Trunking VLANs Enabled:
będąc na konkretnym interfejsie:
switchport trunk allowed vlan add 1001-1005
aby usunąć:
(interface) switchport trunk allowed vlan remove 1001-1005
Oracle – sesje użytkowników.
Aby wyświetlić aktywne sesje użytkowników w bazie danych Oracle:
select b.Username, b.Osuser, b.Process, b.Machine, a.Spid, b.Program, b.Sid, b.Serial# from v$process a, v$session b where a.Addr = b.Paddr ORDER BY b.Machine /
Linuxowe notki.
Aby czysto wyłączyć SQUID:
squid -k shutdown
Monotwanie udziałów sieciowych windows:
mount -t cifs //192.168.0.69/jsen /mnt/sambajsen -o username="jsen",password=tajneHaslo
fstab
//192.168.0.69/jsen /mnt/samba_jsen cifs username=jsen,password=tajneHaslo,rw,user,uid=jsen,guest,noauto 0 0
mount /mnt/samba_jsen
encfs /mnt/samba_jsen/Samba/ /mnt/encfs_Samba/
utworzenie pary zaszyfrowanej i nieszyfrowanej:
encfs ~/Dropbox/crypt/ ~/Dropbox_crypt
późniejsz zamontowanie tych katalogów:
encfs ~/Dropbox/crypt/ ~/Dropbox_crypt